(学校新闻网报道链接:https://news.sicau.edu.cn/info/1078/67623.htm)
近日,Nature旗下国际学术期刊Lab Animal(中科院一区TOP,IF=12.625)以封面论文(Cover Article)的形式,在线发表我校动物医学院实验动物疾病模型研究室题为“Animal models of male subfertility targeted on LanCL1-regulated spermatogenic redox homeostasis(基于LanCL1调控的精子发生过程的氧化还原稳态构建雄性生殖功能障碍动物模型)”的长研究论文。该研究利用基因敲除和转基因的手段,基于抗氧化基因LanCL1,建立了一系列可用于雄性生殖功能障碍研究的实验动物模型,并首次揭示了LanCL1蛋白在精子发生过程中响应并调控精细胞氧化还原平衡及睾丸稳态的作用机制。

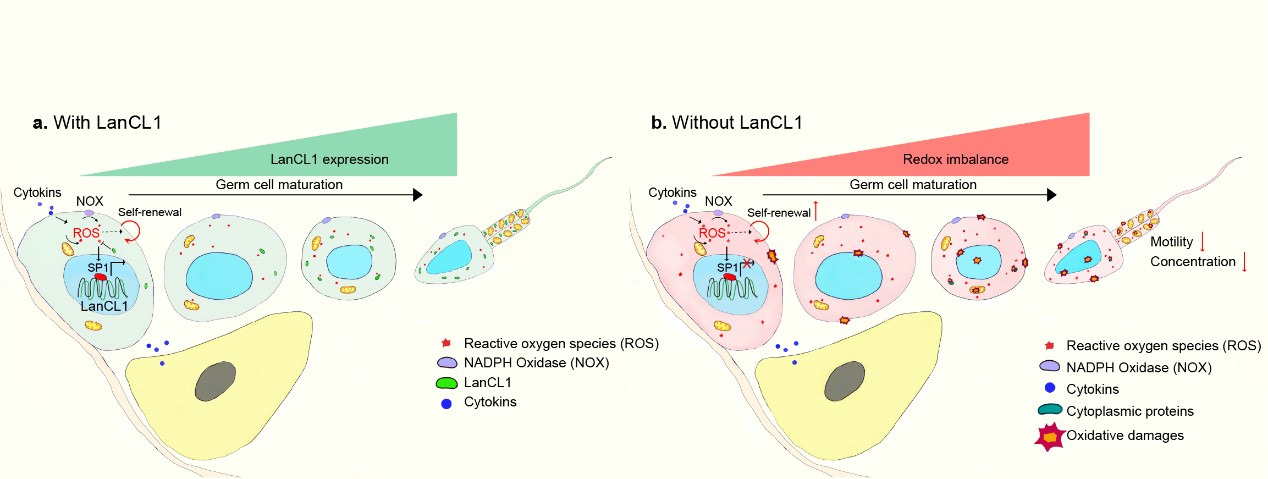
据世界卫生组织预测,在21世纪不育不孕症将成为仅次于肿瘤和心脑血管病的第三大疾病。欧美国家的不育不孕比例已经超过夫妻总数的15%,而其中男性因素占到50%。氧化应激被认为是导致男性生殖功能障碍的重要因素,约50%-80%的男性不育患者中均有发现由活性氧(Reactive oxygen species, ROS)所导致的精细胞氧化损伤。因此,深入研究精子发生过程中氧化还原平衡的调控机制,并基于此建立合适的动物疾病模型具有良好的理论基础和可观的前瞻性。
目前已鉴定的绝大部分细胞氧化还原平衡调控机制在雄性生殖细胞缺失后,都不会对雄性生育能力造成影响,暗示更重要的机制尚待揭示。我校研究团队在前期工作基础上,利用基因敲除和转基因的手段,基于抗氧化基因LanCL1,建立了LanCL1的全身性敲除、生殖细胞特异性敲除及生殖细胞特异性转基因小鼠。发现,LanCL1是一个雄性生殖细胞特异性标志物,其缺失后会打破精细胞发育过程中的氧化还原平衡,进而影响精子发生的稳态,包括精原干细胞的增值、分化,精子的存活以及雄性的生育能力异常。而LanCL1在精细胞特异性过表达后则能抵抗由肥胖引起的精细胞氧化损伤和雄性生育能力下降。此外,该研究还证明了,重要的转录调控因子SP1参与了精子发生过程中LanCL1响应精细胞氧化还原平衡的调控机制。以上研究揭示了SP1-LanCL1轴在雄性生殖系统中重要的生物学功能,以及基于LanCL1的基因修饰小鼠在雄性生殖功能障碍研究中广泛的应用前景。
以上研究由我校联合南方科技大学,四川大学华西医院等单位共同完成,我校为第一完成单位。我校动物医学院黄超和陈正礼教授分别为论文的第一作者和通讯作者,我校2021届硕士研究生杨诚诚及四川大学庞德江博士为共同第一作者,南方科技大学肖波教授和四川大学陈米娜副研究员为论文共同通讯作者。该研究得到了国家自然科学基金(31501200, 31871179, 32071161 to C.H.)、国家科技支撑计划(2014BAI03B01 to ZL.C)和四川农业大学学科建设双支计划的资助。
动物医学院实验动物疾病模型研究室一直以来致力于利用饮食与药物诱导、基因编辑等手段,以非人灵长类动物、小鼠及大鼠等为对象,构建包括神经退行性疾病、代谢性疾病及其并发症、雄性不育在内的众多人类疾病实验动物模型,并在此基础上开展相关疾病病理及其发病机制的研究;同时,也以这些模型为工具,开展相关治疗药物筛选及临床前药效评价的工作。以上研究也是实验动物疾病模型研究室近年来,继在Redox Biology、Translational Neurodegeneration、Frontiers in Microbiology、International Journal of Molecular Sciences、Poultry Science等TOP期刊后,发表的又一项重要成果。
文章链接:https://www.nature.com/articles/s41684-022-00961-w